Альдегиды — химические соединения, имеющие общую формулу R–CHO (R — алкильная или арильная группа). Название это класса веществ происходит от alcohol dehydrogenatum, указывая на тот факт, что они могут быть получены окислением спиртов.
Низшие альдегиды — нейтральные жидкости с характерным запахом, растворимые в воде и летучие (формальдегид, например, при нормальной температуре представляет собой газ). По мере увеличения содержания углерода, растворимость альдегидов в воде уменьшается, а запах становится менее выраженным с одновременным увеличение температуры точки кипения. Высшие альдегиды — твёрдые вещества, перегнать которые без разложения можно только под вакуумом.
Получение альдегидов
Альдегиды можно получить окислением первичных спиртов смесью бихромата калия и серной кислоты:
3 R–CH2–OH + K2Cr2O7 + 4 H2SO4 = K2SO4 + Cr2(SO4)3 + 7 H2O + 3 R–CHO;
а также дистилляцией кальциевых солей жирных кислот с форматом кальция или гидролизом ацеталей.
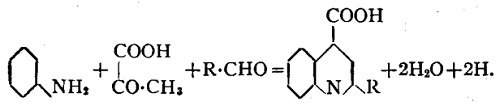
Кроме того, альдегиды образуются при постепенном добавлении двузамещённых формамидоы (растворённых в безводном эфире) к галоидным магний-алкилам, наилучший выход получается при использовании диэтилформамида. В то же время идут вторичные реакции, в ходе которых образуются углеводороды жирного ряда.
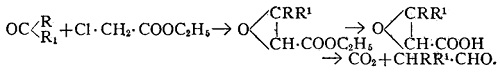
Эфиры двузамещённых глицидных кислот получают конденсацией соответствующего кетона с с монохлоруксусной кислотой в присутствии этилата натрия. Эти эфиры при гидролизе дают свободные кислоты, который легко разлагаются с образованием углекислого газа и образованием альдегида:
Взаимодействие двух молей алкилформата с двумя молями магний-алкила (или арила) даёт комплексное соединение, легко разлагающееся на основную магниевую соль и альдегид:
C6H5MgBr + HCOO–R → R–O–CH–C6H5–OMgBr → MgBrO–R + C6H5CHO
Реакции
Альдегиды обладают высокой химической активностью. Они действуют как восстановители, нитрат серебра в присутствии нашатырного спирта быстро восстанавливается до металлического серебра.
Альдегиды легко окисляются до соответствующих жирных кислот, во многих случаях — просто под действием кислорода воздуха. Атомарный водород восстанавливает их до первичных спиртов, а пентахлорид фосфора замещает кислород карбонильной группы хлором.
Альдегиды образуют много продуктов присоединения, соединяясь с аммиком и образуя альдегидаммиачные соединения вида R–CH(OH)–NH2. Эти вещества представляют собой бесцветные кристаллические соединения, наиболее просто их получить, пропуская аммиак через эфирный раствор альдегида.
С бисульфитом натрия альдегиды дают бисульфиты строения R–CH(OH)–SO3Na, который легко распадается на составляющие при перегонке с разведенными кислотами, и часто используется для приготовления чистых альдегидов.
С синильной кислотой альдегиды образуют циангидрины R–CH(OH)–CN. Они реагируют с гидроксиламином и фенилгидразином, что приводит к появлению альдоксимов и гидразонов. Гидразоны — кристаллическое вещества, полезные для понимания характеристик альдегидов. И оксимы, и гидразоны при кипячении с разведенной кислотой восстанавливаются до соответствующих по строению альдегидов. Гидразоны получают смешиванием альдегида и фенилгидразина в разведенной уксусной кислоте в отсутствие любой минеральной кислоты. Семиоксамазид NH2–CO–CO–NH–NH2, также применяется для идентификации альдегидов.
Под действием едких щелочей альдегиды преобразуются в смолы. При нагревании со спиртами до 100° C образуют ацетали, а также дают продукты конденсации с параамидодиметиланилином.
Взаимодействуя с цинк-алкилами альдегиды образуют продукты присоединения, которые разлагаются водой, давая вторичные спирты, так:
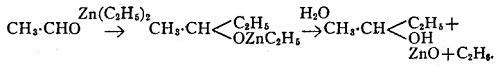
Реакция общая для всех альдегидом с метилатом цинка и этилатом цинка, но не с высшими цинк-алкилами.
Альдегиды соединяются с йодистыми магний-алкилами (в растворе абсолютного эфира) с образованием продуктов присоединения, которые разлагаются водой, давая вторичные спирты. Так, из ацетальдегида и йодметилита магния можно получить изопропиловый спирт:
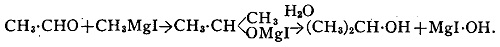
Низшие члены алифатического ряда характеризуются их способностью к полимеризации (см. «Формалин»), а также к т. н. «альдольной конденсации» — ацетальдегид, например, таким образом формирует альдоль CH3–CHOH–CH2–CHO. Эти альдоли обычно легко теряют воду и переходят в ненасыщенное состояние; сам альдоль в ходе дистилляции под атмосферных давлением образует кротоновый альдегид CH3–CH=CH–CHO.
В растворах фуксина альдегиды дают красновато-фиолетовый цвет, который исчезает под действием серной кислоты. С диазобензолсульфоновой кислотой в присутствии щёлочи и следах натриевой амальгамы при стоянии появляется красновато-фиолетовое окрашивание. В присутствии нитрогидроксиламиновой кислоты образуется гидроксамовая кислота. Альдегиды легко конденсируются до пиридинов с ацетоуксусным эфиром в присутствии аммиака, тогда как анилин и серная кислота даёт замещённые хинолины.
Представители
Главнейшие из альдегидов представлены в следующей таблице:
| Наименование | Формула | Температура кипения | Температура плавления |
| Формальдегид | H–CHO | −21° | |
| Ацетальдегид | CH3–CHO | 20,8° | |
| Пропиловый альдегид | CH3–CH2–CHO | 49° | |
| n-Бутиловый -""- | CH3–(CH2)2–CHO | 75° | |
| Изобутиловый -""- | (CH3)2CH–CHO | 61° | |
| n-Валериановый -""- | CH3–(CH2)3–CHO | 103° | |
| Изовалериановый -""- | C4H9–CHO | 92° | |
| Энантиловый -""- | CH3–(CH2)5–CHO | 155° | |
| Капроновый -""- | CH3–(CH2)8–CHO | 121° | |
| Лауриновый -""- | CH3–(CH2)10–CHO | 44,5° | |
| Миристиновый -""- | CH3–(CH2)12–CHO | 52,5° | |
| Пальмитиновый -""- | CH3–(CH2)14–CHO | 58,5° | |
| Стеариновый -""- | CH3(CH2)16–CHO | 63,5° | |
| Акролеин, аллиловый альдегид | CH2=CH–CHO | 52° | |
| Кротоновый -""- | CH3–CH=CH–CHO | 104° | |
| Тиглиновый (гваяколовый) -""- | CH3–CH=C–CH3–CHO | 116° | |
| Пропаргиловый альдегид | CH=C–CHO | 59° | |
| Бензальдегид | C6H5–CHO | 179° | |
| Толуиловый альдегид | C6H4–CH3–CHO | ||
| орто- | 200° | ||
| мета- | 199° | ||
| пара- | 204° | ||
| Куминовый -""- | C6H4–C3H7–CHO | 235° | |
| Коричный -""- | C6H5–CH=CH–CHO | 247° |
Формальдегид. — см. «Формалин».
Ацетальдегид. — CH3–CHO, обнаружен Шееле в 1774 году, выделен и исследован Либихом в 1835 году. Получается окислением этилового спирта разведенной серной кислотой и бихроматом калия. Представляет собой бесцветную жидкость с температурой кипения 20,8° C, обладающую характерным запахом. Удельный вес ацетальдегида = 0,8009 (0° C). Во всех пропорциях смешивается со спиртом, эфиром и водой.
Легко полимеризуется небольшими количествами соляной кислоты, хлорида цинка, хлорокиси углерода, превращаясь, при нормальной температуре, в паральдегид (C2H4O), жидкость, кипящую при 124° C, с удельным весом 0,998 (15° C). Паральдегид умеренно растворим в воде, при перегонке с серной кислотой возвращается к обычной форме. Паральдегид окисляется разведенной азотной кислотой, образуя глиоксаль, (CHO)2 (для трихлорацетальдегида см. «Хлораль»). Метальдегид, (C2H4O)3, образуется сходным с паральдегидом способом, но при более низкой температуре (т. е. с применением охлаждающей смеси). Представляет собой кристаллическое твёрдое вещество, сублимирующееся при 112–115° C. Нерастворим в воде, слабо растворим в спирте и эфире. При нагревании в запечатанной пробирке при 120° C полностью возвращается к обычной форме.
Действие ацетальдегида на спирт по 100° C приводит к образованию ацеталя CH3–CH(OC2H5)2. Он может быть получен и окислением этилового спирта диоксидом марганца и серной кислотой. Представляет собой бесцветную жидкость с удельным весом 0,8314 (20°/4°) и температурой кипения 104° C. Разведенные кислоты легко превращают его в спирт и альдегид, а хромовая кислота окисляет до уксусной кислоты. Описаны хлор- и бромацетали.
Тиоальдегиды получают действием сернистого водорода на водные растворы ацетальдегида. Полученная смесь при после дистилляции или после обработки соляной кислотой даёт тритиоальдегид, (C2H4S)3.
Аммониевый альдегид, CH3–CH(OH)–NH2, образуется при пропускании осушенного аммиака через эфирный раствор ацетальдегида. Аммониевый альдегид кристаллизуется в блестящие ромбоэдры, плавится при 70–80° C и кипит при 100° C. Полностью распадается на составляющие при нагревании с разведенными кислотами.
Высшие альдегиды напоминают ацетальдегид по общим свойствам. Известны ненасыщенные альдегиды, соответствующие спиртам олефинового ряда; они проявляют свойства насыщенных альдегидов, но могут образовывать продукты присоединения вследствие своей ненасыщенности.
Акролеин. — C3H4O, или CH2=CH–CHO — простейший представитель ряда, который можно получить окислением аллилового спирта, или отрывая воду от глицерина при его нагревании с безводным бисульфатом калия. Также получается действием натрия на смесь эпихлоргидрина и метилйодида:
C3H5OCl + CH3I + 2 Na = C3H4O + NaI + NaCl + CH4
Акролеин представляет собой бесцветную жидкость с очень едким запахом, сильно раздражающую слизистые оболочки. Кипит при 52,4° C, растворим в воде. Легко окисляется: действие воздуха на акролеин приводит к образованию акриловой кислоты, азотная кислота превращает его в щавелевую, бихромат калия и серная кислота дают углекислый газ и муравьиную кислоту. Акролеин реагирует с бромом с образованием дибромида, из которого обработкой баритовой водой (раствором гидроксида бария) получают синтетические сахара — α- и β-акрозы.
Метакролеин, (C3H4O)3 — полимер акролеина. Пропусканием паров акролеина через нашатырный спирт получают аммоний-акролеин, C6H9NO — красноватуют аморфную массу, нерастворимую в спирте, при перегонке дающую пиколин (метилпиридин).
Цитронеллаль, родиналь и гераниаль. — Также относятся к ненасыщенным альдегидам. (см. «Терпены»).
Ароматические альдегиды по многим своим свойствам напоминают алифатические альдегиды, но в некоторых реакциях ведут себя совершенно иным образом. Они не полимеризуются, а в присутствии едких щелочей не превращаются в смолы, вместо этого окисляясь до спиртов и кислот (см. «Бензальдегид» и «Реакция Канниццаро»). При нагревании со спиртовым раствором цианида калия образуются бензоины.
Ванилин не даёт реакции Канниццаро, но со спиртовым раствором калийной щёлочи образует ванилиновую кислоту, HOOC(1)–C6H3–OCH3(3)–OH(4), и ваниллоин. С аммиаком бензальдегид не образует аммониевого альдегида, вместо этого конденсируясь до гидробензамида, (C6H5CH)3N2, с отщеплением воды. Куминовый альдегид (куминал), (CH3)2CH(1)C6H4–CHO(4), обнаружен в масле тмина римского и веха ядовитого. Это жидкость, кипящая при 235° C, с удельным весом 0,973. При перегонке с цинковой пылью образует цимен (1,4-метилизопропилбензол).
Салициловый альдегид. — Ортогидроксибензальдегид, HO(1)C6H4–CHO(2) – ароматический оксиальдегид, бесцветная жидкость, с точкой кипения 196° C и удельным весом 1,172 (при 15° C). Обнаружен в эфирных маслах таволги, может быть получен окислением глюкозида салицина, (C13H18O7), содержащегося в коре ивы. Обычно получает реакцией Реймера, в которой хлороформ реагирует с фенолом в присутствии едкой щёлочи:
C6H4OH + CHCl3 + 4 KOH = 3 KCl + 3 H2O + KO–C6H4–CHO,
с одноременным образованием некоторого количества параоксибензальдегида. Это летучее вещество (параоксибензальдегид — нет) дающее фиолетовое окрашивание с трёххлористым железом. Для диоксибензальдегида и его производных см. «Пиперонал» и «Ванилин».
Коричный альдегид. — β-фенилакролеин, C6H5–CH=CH–CHO, ненасыщенный ароматический альдегид, главное составляющее коричного масла. Получается окислением коричного (циннамилового) спирта, или действием этилата натрия на смесь бензальдегида и ацетальдегида. Бесцветная ароматная маслянистая жидкость, кипящая при 247° С, легко окисляющаяся под действием воздуха.
Конденсация альдегидов с пировиноградной кислотой и нафтиламинами даёт α-алкилнафтохинолин-γ-карбоновые кислоты, та же реакция обычно имеет место с ароматическими аминами: