Спирты — в органической химии, класс соединений, которые могут рассматриваться как производные углеводородов, один атом водорода которых заменён гидроксильной группой (–OH).
Традиционно термин «спирт» применяется только к веществам, гидроксильная группа у которых присоединена к алифатическому остатку; это исключает такие соединения, как гидроксибензолы, нафталины и т. п., которые по своим свойствам сильно отличаются от производных алифатических алкилов.
Спирты классифицируются, основываясь на двух основных принципах, первая классификация учитывает количество имеющихся гидроксильных групп, вторая опирается на то, какие группы присоединены к атому углерода, несущему гидроксильную группу. Одноатомные спирты содержат только одну гидроксильную группу; двухатомные (гликоли) — две, трёхатомные (глицерины) — три, и т. д.
По второй классификации спирты делятся на три группы — первичные, вторичные и третичные.
Происхождение и формулы этих спиртов легко понять, если принять во внимание отношение спирта к порождающему его углеводороду. У метана, CH4, например, все атомы водорода равнозначны, и он даёт только один первичный спирт — простейший из всех, спирт метиловый, CH3OH. Этан, C2H6, также образует только один первичный спирт, а именно спирт этиловый, CH3sub>CH2OH. Пропан, CH3CH2CH3, может давать начало двум спиртам — первичному CH3CH2CH2OH (нормальный пропиловый спирт), в котором атом водорода замещён на концевом атоме углерода, и вторичному CH3–CH(OH)–CH3 (изопропиловый спирт), где замещение водорода происходит на центральном атоме углерода. Группа –CH–OH характерна для вторичных спиртов, изопропиловый спирт — простейший их представитель.
Бутан, C4H10, имеет два изомера — нормальный бутан CH3–CH2–CH2–CH3, и изобутан CH(CH3)3. Каждый из этих углеводородов даёт начало двум спиртам: n-бутан — первичному и вторичному, а изобутан — первичному (при замещении водорода в одной из метильных групп –CH3) и третичному (при замещении водорода в группе ≡CH). Таким образом, третичные спирты характеризуются наличием группы ≡C–OH, в которой остаточные валентности углерода образуют связь с алкильной группой.
Для метилового спирта (карбинола), как простейшего из спиртов, замещение одного атома водорода в метильной группе алькильным остатоков даёт соединения с общей формулой R–CH2–OH. Это первичные спирты. При замещении двух водородных атомов одинаковыми или разными алкилами, возникают соединения с формулой (R–R1)CH–OH — вторичные спирты; тогда как при присоединении трёх алкилов вместо атомов водорода появляются спирты вида (R–R1–R2)C–OH, то есть третичные спирты.
Можно провести сравнение между этими тремя типами спиртов и аминами, где:
- R–NH3 и R–CH2OH — первичные;
- (R1–R2)NH и (R1–R2)CH–OH — вторичные; и
- (R1–R2–R3)N и (R1–R2–R3)C–OH — третичные.
Различия между первичными, вторичными и третичными спиртами
Различия между тремя типами спиртов можно показать многочисленными реакциями.
Главным различием между ними является поведение при окислении. Первичные спирты окисляются вначале до альдегидов, которые, при дальнейшем окислении, дают кислоты, содержащее то же количество углеродных атомов, что и породивший их спирт. При окислении вторичных спиртов возникают кетоны, при последующем окислении превращающиеся в смесь двух кислот. Третичные спирты при восстановлении не образуют ни альдегидов, ни кетонов, образуя при этом смеси двух и более кислот.
Другой метод, показывающий различия между спиртами заключается в изучении взаимодействия соответствующего нитроалкила с азотистой кислотой. Вначале на спирт действуют фосфором и йодом, после чего полученный алкилйодид обрабатывают нитритом серебра, что даёт соответствующий нитроалкил. Затем на нитроалкил действуют нитритом калия, разведенным в концентрированном растворе гидроксида калия, и добавляют серную кислоту — первичные нитроалкилы дают нитроловую кислоту, калиевая соль которой образует интенсивно-красный раствор; вторичные нитроалкилы дают псевдонитрол с образованием интенсивно-синего раствора, тогда как третичные соединения не взаимодействуют с азотистой кислотой.
Реакции, описанные выше могут быть представлены как:
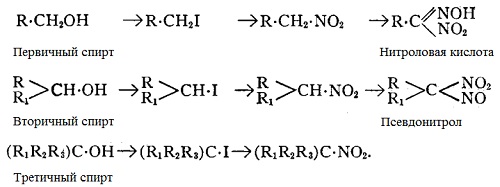
При нагревании до точки кипения нафталина (218° C) третичные спирты разлагаются, а нагрев до точки кипения антрацена (360° C) приводит к разложению вторичных спиртов, первичные спирты при этом термическому разложению не подвергаются. Эти изменения можно отследить по изменению плотности паров.
Получение спиртов
Различные спирты легко получаются из соответствующих галоидных алкилов действием влажного оксида серебра (который ведёт себя как гидроксид серебра); омылением их эфиров; или восстановлением многоатомных спиртов йодистоводородной кислотой с последующим окислением полученного алкилйодида до спирта влажным оксидом серебра.
Первичные спирты можно получить при разложении их сернокислых эфиров (серная кисота + олефин) кипящей водой; действием азотистой кислоты на первичные амины; или восстановлением альдегидов, хлорангидридов или ангидридов кислот.
Вторичные спирты получаются восстановлением кетонов, а также реакцией алкилов цинка на альдегиды или эфиры муравьиной кислоты.
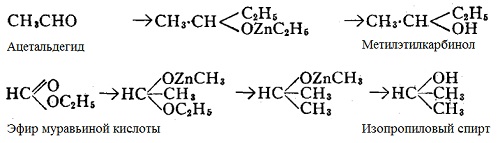
Третичные спирты получают действием алкилов цинка (метил- или этил-) на хлорангидриды — при этом сначала образуется соединения, разлагаемое с водой до кетона. Если затем ввести в реакции вторую молекулу цинк-алкила, полученной соединений разлагается водой с образованием третичного спирта.
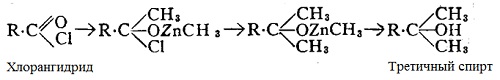
Интересно, что хотя метил- и этилалкилы цинка дают третичные спирты, пропиловый образует только вторичные. Много синтезов можно провести и с использованием галоидных магний-алкилов.
Свойства
Спирты обладают нейтральным характером, низшие могут образовывать соединения с солями, в которых спирт играет роль, аналогичную кристаллизационной воде. Натрий и калий растворяются в спиртах с образованием алкоголятов, при этом водород в гидроксильной группе замещается металлом. Под действием сильных кислот от спиртов отщепляется вода и образуются эфиры. Галоидные эфиры спиртов жирного ряда образуются при нагревании спирта с галоидными кислотами, их можно получить и нагреванием галоидных соединений фосфора со спиртом. Энергичная дегидратация даёт олефиновые углеводороды, но при некоторых условиях получаются и эфиры.
Физические свойства спиртов меняются пропорционально их молекулярной массе. Низшие спирты — бесцветные подвижные жидкости, легко растворимые в воде, обладающие характерным запахом и вкусом. По мере увеличения числа атомов углерода в молекуле растворимость спиртов падает. Нормальные спирты, содержащие от 1 до 16 атомов углерода при нормальной температуре представляют собой жидкости; высшие члены ряда — кристаллические вещества без вкуса и запаха, по внешнему виду сходные с жирами.
Температура точки кипения нормальных спиртов растёт с регулярным шагом около 10° C при добавлении в цепь каждой группы –CH2–; это типично для всего гомологических рядов органических соединений. Для первичный, вторичных и третичных спиртов с одинаковой эмпирической формулой, первичные имеет самую высокую, а третичные — самую низкую точку кипения, это связано с общим правилом, что нарушение симметрии молекулы снижает температуру кипения соединений.
